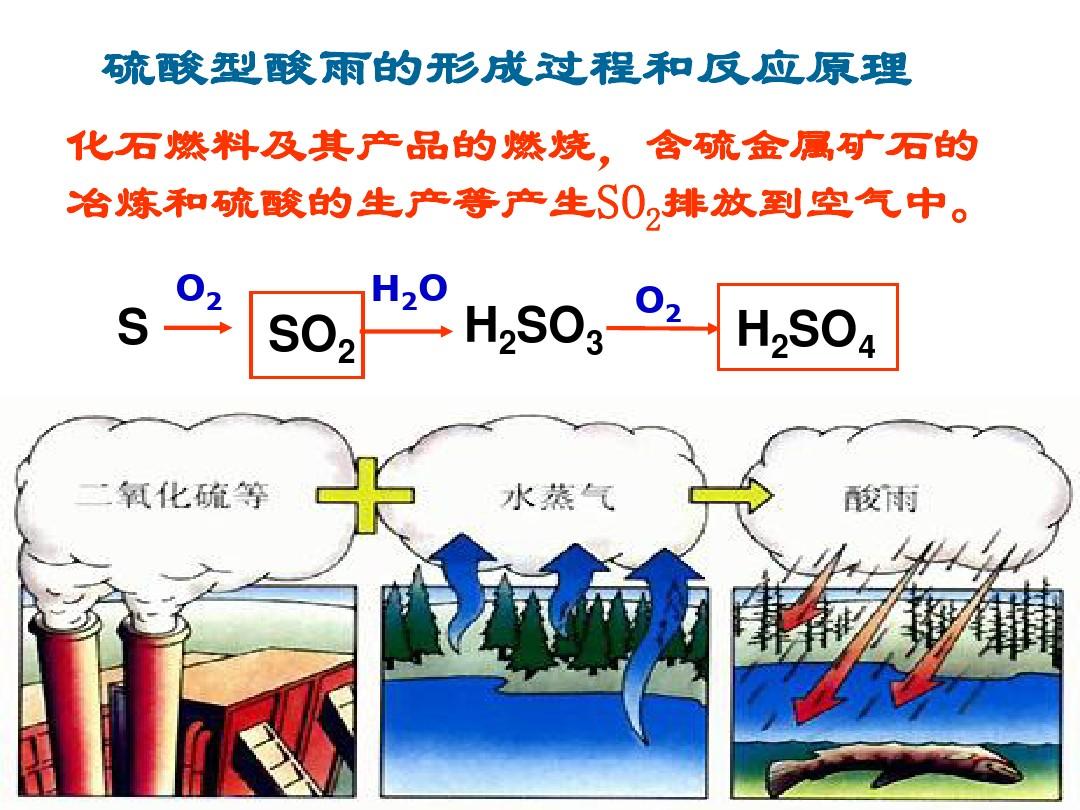
氢硫酸(H₂S)在空气中会与氧气(O₂)发生反应,生成单质硫(S)和水(H₂O),其反应方程式为:2H₂S + O₂ = 2S↓ + 2H₂O。这个反应是放热反应,且生成的硫单质为黄色沉淀,因此当氢硫酸暴露在空气中时,我们可以观察到其颜色逐渐变黄,并散发出臭鸡蛋气味。这个现象被称为氢硫酸的“变质”。
在化学的浩瀚世界里,每一种物质都拥有其独特的性质与反应,而氢硫酸(H₂S)作为一种具有强烈臭鸡蛋气味的无色液体,其与空气的接触反应尤为引人注目,本文将深入探讨氢硫酸在空气中变质的现象、原因、以及这一过程对化学教育、工业应用和环境保护的启示。
一、氢硫酸的简介与特性
氢硫酸,化学式为H₂S,是一种二元无机化合物,由氢和硫通过共价键连接而成,它在常温常压下为无色透明液体,但具有强烈的刺激性臭味,这是由于其分子结构中硫原子的特殊电子排布所致,氢硫酸的这种特性使其在实验室中常被用作检测某些气体的存在,如钡离子(Ba²⁺)的检测试剂,正是这种独特的性质,使得氢硫酸在接触空气时极易发生变质反应。
二、氢硫酸在空气中的变质现象
当纯净的氢硫酸暴露于空气中时,其表面会逐渐形成一层淡黄色的薄膜,这是由于氢硫酸与空气中的氧气(O₂)发生氧化反应的结果,具体而言,氢硫酸首先与氧气反应生成单质硫(S),同时释放出二氧化硫(SO₂),反应方程式可表示为:
\[ 2H₂S + O₂ → 2S + 2H₂O \]
这一过程中释放的水分可能进一步促进反应的进行,而生成的硫单质则以微小颗粒的形式沉积在液体表面,形成肉眼可见的淡黄色薄膜,随着时间推移,这层薄膜会逐渐增厚,直至完全覆盖整个容器口部,标志着氢硫酸的变质过程基本完成。
三、变质的原因分析
1、氧气的存在:如前所述,氧气是导致氢硫酸变质的主要因素,在有氧环境下,氢硫酸中的硫元素被氧化为更稳定的硫单质,这是自然界中常见的氧化还原反应之一。
2、水分的作用:虽然水不直接参与化学反应,但它为反应提供了必要的环境条件,水分的存在促进了氧气的溶解和扩散,加速了氢硫酸与氧气的接触和反应速率。
3、温度与浓度的影响:温度升高和氢硫酸浓度的增加都会加速变质过程,高温下分子运动加剧,反应速率加快;高浓度则意味着更多的反应物分子参与反应。
四、对化学教育的启示
氢硫酸在空气中的变质现象是化学教学中一个生动的实例,它不仅展示了氧化还原反应的实质,还让学生直观地理解了化学反应条件对速率的影响,通过实验观察和理论讲解相结合的方式,可以加深学生对化学原理的理解和记忆,培养他们的实验观察能力和科学思维方法,这一现象也常被用来引导学生思考如何通过控制条件来减缓或阻止某些不希望发生的化学反应,从而增强他们的安全意识和问题解决能力。
五、工业应用中的考量
在工业生产中,了解并控制氢硫酸的变质过程对于保证产品质量和安全生产至关重要,在制造过程中使用氢硫酸作为还原剂或催化剂时,必须采取适当的措施来减少其与空气的接触时间,如使用密封容器、氮气保护等手段,变质过程中产生的二氧化硫若不加以妥善处理,可能对环境造成污染,因此工业上还需设计有效的尾气处理系统来吸收或转化这些有害气体。
六、环境保护的视角
从环境保护的角度看,氢硫酸在空气中的变质不仅是一个化学现象,也是对环境友好型生产方式的一种警示,变质过程中释放的二氧化硫若未经处理直接排放到大气中,会加剧酸雨的形成,对水体、土壤和建筑物造成损害,在利用氢硫酸进行生产活动时,必须采取措施减少其负面影响,如采用先进的尾气净化技术、优化工艺流程以降低二氧化硫的产生等,这不仅是对自然环境的尊重,也是对未来可持续发展的承诺。
七、结语
氢硫酸在空气中的变质现象不仅是化学领域的一个基本而重要的实验观察结果,它还涉及到化学教育、工业应用以及环境保护等多个层面,通过深入理解这一过程,我们不仅能够更好地掌握化学反应的原理和规律,还能在实际应用中采取有效措施来减少不必要的损失和污染,促进科学技术的健康发展,正如自然界中无数微妙的平衡一样,人类在利用自然的同时也应保持敬畏之心,学会与自然和谐共存。





 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号